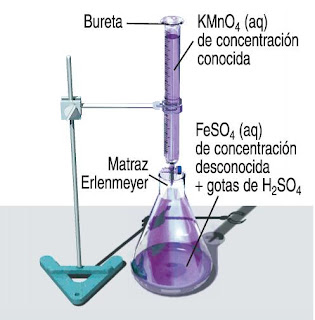
Tomando en cuenta el temario de Química II, para resolver el material de apoyo proporcionado en clase, tenemos:
UNIDAD 2. TANTA AGUA Y NOS PODEMOS MORIR DE SED.
Agua: líquido incoloro, inodoro e insípido, indispensable para la vida (aunque se puede presentar en los tres estados de agregación: sólido si es hielo, líquido, y en forma de vapor o gas).
2.1.1. DISTRIBUCIÓN DEL AGUA EN LA TIERRA.
De la revista Ciencia y Desarrollo, Volumen 32, Número 192, Marzo 2006, México, páginas 26 - 29, del artículo "Agua en el Mundo", artículo presentado por La Comisión Nacional del Agua, se puede destacar los siguientes aspectos importantes sobre el agua:
"El agua es un elemento básico en la vida para mantener tanto un equilibrio ecológico como en el desarrollo socioeconómico de los seres humanos. A la mayoría de nosotros nos parece natural tener acceso al agua potable; la usamos, la dejamos correr y suponemos que siempre ha estado y estará ahí.
(Sin embargo, el agua es) Un recurso limitado. En la mayoría de los países se reconoce que el agua es un recurso limitado. El crecimiento demográfico, la expansión y la diversificación productiva han afectado severamente a los recursos hídricos, (tanto) en su cantidad como en su calidad.
Así, del 75 al 71 % de la superficie terrestre está cubierta por agua, de la cual el 98 % del volumen de agua de la Tierra se encuentra en mares y océanos, 2.5 % es agua dulce, de la cual sólo el 0.32 % puede aprovecharse para el consumo humano y el 97.5 % restante se concentra en los glaciares, la atmósfera o en los mantos acuíferos a cientos de metros de profundidad.
En el Mundo, la mayor parte del agua se concentra en algunas cuencas como la de Siberia, en la región de los grandes lagos de Norteamérica, en los lagos de Tanganica, Victoria y Malawi en África, y en cinco sistemas fluviales: Amazonas, Ganges, Brahmaputra, el Congo, Yangtze y Orinoco.
El Continente Americano, en general, es rico en recursos hídricos, sin embargo, en esta zona, la urbanización acelerada y el crecimiento de la población han generado un incremento de la demanda de agua y de la necesidad de transferirla desde las cuentas.
En Norteamérica la cobertura de abastecimiento y saneamiento de agua es la más elevada del mundo. En América Latina y el Caribe: aunque cuentan con niveles de servicio de agua potable y saneamiento relativamente altos, se caracterizan por marcadas diferencias entre la población rural y urbana.
Europa: Si bien la escasez o la deficiente calidad del agua afectan a un porcentaje muy reducido de la población, los recursos hídricos no están distribuidos equitativamente. En la parte sur y este de Europa se requiere intensificar las acciones de saneamiento, asimismo, en muchas partes, la infraestructura, que tiene más de 100 años se ha deteriorado.
Región Asia - Pacífico: Existe una gran variedad de asuntos críticos relacionados con el agua, en las partes norte y sur, el principal problema son los impactos provocados por desastres naturales; en Asia Central, las cuencas transfronterizas; en el sureste, el saneamiento y la pobreza, mientras que en la zona de Oceanía - Pacífico lo que preocupa es el cambio climático.
Medio Oriente: Más del 85 % del territorio esta clasificado como tierras áridas e hiperáridas. La falta de agua, el deterioro de su calidad, su administración fragmentada y el saneamiento, son los retos más importantes para la región-
África: 135 millones de personas se han visto afectadas por las sequías durante los últimos diez años en África. Es quizás el continente que mayor preocupación genera debido a la relación directa que existe entre la falta de acceso a recursos hídricos de calidad y la pobreza. Además, cuenta solamente con 9 % de los recursos mundiales de agua dulce. Las cifras son abrumadoras. En 43 de las grandes ciudades de África, 19 % de la población no cuenta con algún tipo de servicio de agua potable y saneamiento, carencia que ha generado una situación de crisis en materia de salud en diversas regiones del continente".
Otro artículo de la misma revista es "Agua en Cifras", páginas 48 y 49, cuyas fuentes de información es la Comisión Nacional del Agua:
"En los países desarrollados se consume diez veces más agua que en los países en desarrollo.
(De) 500 a 800 litros por día consume una persona en países desarrollados (300 m3 por año).
20 m3 por año consume un habitante de los países en desarrollo (entre 60 y 150 litros por día).
4841 m3 de agua al año le corresponde en promedio a cada mexicano.
Mientras un individuo de Baja California dispone de menos de mil metros cúbicos al año, uno de Chiapas dispone de cerca de 15 mil.
EN EL ÁMBITO MUNDIAL:
40 % (de la población) no cuenta con servicios de saneamiento básico. Se estima que 2,400 millones de personas carecen de servicios de saneamiento básico y más de 5 millones de personas mueren cada año por infecciones prevenibles relacionadas con el agua.
1,180 millones de personas (17 % de la población mundial) no tienen acceso al agua potable.
FUENTES DE EXTRACCIÓN DE AGUA EN LA CD. DE MÉXICO:
Río Magdalena 25 %, Ríos Lerma y Cutzamala el 24 % y mantos acuíferos el 51 %. El volumen de agua extraída de los acuíferos es mayor que el de recuperación natural por medio de la lluvia. Cada segundo se extraen del subsuelo 45 metros cúbicos y sólo se reponen 25.
EN MÉXICO:
76 % (es de) uso agropecuario. Incluye el agua aplicada en cultivos agrícolas, a manejo pecuario y acuacultura, lo cual representa el empleo de 6.5 % del total.
El 10 % es para la industria autoabastecida. Conforman este rubro los usos industrial, agroindustrial, servicios y generación de energía eléctrica (excepto hidroeléctricas).
89.5 % (Hay) cobertura nacional promedio de agua potable. Es el porcentaje del territorio nacional que cuenta con este servicio (esto comprende pozos, plantas potabilizadoras, red de distribución, drenaje, etcétera). Cabe destacar que 23 estados superan este promedio (ejemplo: Aguascallientes, Coahuila, Colima y Ciudad de México), con coberturas superiores a 98 %. En contraste, nueve estados registran promedios inferiores al promedio como Guerrero, Oaxaca, Tabasco y Veracruz, cuyo promedio es de 75 %.
EXISTEN APROXIMADAMENTE:
4000 presas de almacenamiento.
6.3 millones de hectáreas con riego.
2.8 millones de hectáreas con temporal tecnificado.
1182 plantas de tratamiento de aguas residuales municipales en operación.
1579 plantas de tratamiento de aguas residuales industriales en operación.
120 plantas desaladoras en operación.
3000 kilómetros de acueductos".
2.1.2. CALIDAD DEL AGUA.
En el siguiente vídeo se analizan los parámetros físicos, químicos y biológicos para determinar la calidad del agua.
2.1.3. FUENTES DE CONTAMINACIÓN.
En el siguiente vídeo se analizan las fuentes de contaminación del agua (las cuales también se observaron en otro vídeo en la entrada anterior):